
Le Mot du Président (Dr Jean Bachet)
Chers Adhérents, Chers amis,
 Nous voici, donc, réunis physiquement ou en pensée pour notre Assemblée générale annuelle.
Nous voici, donc, réunis physiquement ou en pensée pour notre Assemblée générale annuelle.
Comme je l’indiquais dans le petit texte écrit pour la convocation à cette assemblée, il s’agit d’une obligation légale à laquelle nous ne saurions nous soustraire. Mais il me semble que, plus encore, c’est un moment privilégié où nous pouvons nous retrouver, entendre et discuter les actions, les buts, les résultats de notre action commune en faveur de la recherche cardio-vasculaire et d’envisager l’avenir.
Aussi je voudrais remercier chaleureusement ceux d’entre vous qui se sont déplacés et dire à tous ceux qui n’ont pu le faire mais qui nous ont confié leurs pouvoirs combien nous sommes sensibles à leur fidélité.
A ce sujet, comme nous l’avons déjà évoqué l’an dernier et dans les bulletins récents, notre secrétaire général, Monsieur Malgoire, et notre secrétaire général adjoint, Monsieur Grevoul, travaillent d’arrache-pied à mettre en place la possibilité de vote par correspondance et par Internet. Mais ceci est difficile car les recommandations et les obligations mises en place par, d’une part la CNIL et d’autre part le Ministère de l’Intérieur, sont très lourdes et demandent de nombreux échanges et consultations. Mais nous ne doutons pas d’y parvenir dans un avenir proche. Ceci permettra à l’écrasante majorité des adhérents de voter sur les propositions et décisions du Conseil d’Administration et de l’Assemblée Générale.
Quoi qu’il en soit, et comme vous vous en doutez, l’action de l’ADETEC s’est maintenue et développée durant l’année écoulée.
Outre le renouvellement des mandats de trois membres du conseil pour lequel votre vote va être sollicité, nous avons pu, grâce à votre générosité et à la bonne santé de notre trésorerie, financer les 2 importants projets de recherche et les 6 bourses de doctorants ainsi que le modeste projet humanitaire acceptés dans le courant de l’année passée.
Ainsi le projet de recherche mené à l’IMM recherche sous la direction du Dr. Nicolas Borenstein et concernant l’exploration et la vision directe des structures endo-cavitaires sur cœur battant a été mené à bien et a fait l’objet d’une présentation au Congrès de la World Society of Cardio-Thoracic Surgery en septembre 2015.
De même l’ADETEC a pu largement financer la mise en place du registre international AVIATOR qui doit s’efforcer de regrouper les résultats des différents traitements des maladies de la valve aortique dans plusieurs pays occidentaux.
Enfin le projet de formation, à l’IMM et au CHU de Nantes, de personnel technique compétent pour un nouveau service de chirurgie cardiaque à Dakar, a été mis en place.
En ce qui concerne les bourses acceptées et financées, elles concernent des sujets très variés et qui de plus en plus s’intéressent à la biologie plutôt qu’à la mise au point de procédés techniques ou matériels.
Ainsi les travaux menés au CHU de Clermont-Ferrand par le Dr. Azarnouche sur les facteurs biologiques des défaillances cardiaques au cours de septicémies gravissimes et leur possible traitement sont en bonne voie et devraient aboutir à une ou plusieurs publications.
Par ailleurs et comme nos adhérents n’auront pas manqué de le constater, l’ADETEC a financé depuis plusieurs années un certain nombre de travaux concernant l’hypertension artérielle pulmonaire et son retentissement délétère sur le fonctionnement du ventricule droit. Ces travaux ont été réalisés essentiellement au laboratoire de l’Hôpital Marie-Lannelongue. C’est dans ce cadre et dans cette perspective thérapeutique que s’inscrivent les bourses attribuées cette année aux Dr. Langer (qui vient des Etats-Unis) et au Dr. Provost.
Enfin les bourses des Drs. Rouzé et Couture acceptées pour 2015 et déjà financées concernent la mise au point de matériels techniques, d’imagerie pour le premier et de robotique pour le second, et destinés à la chirurgie vasculaire et pulmonaire.
L’année 2016 n’est cependant pas en reste. En effet au cours de l’année passée un nombre non négligeable de demandes de bourse nous a été adressé. Parmi ces demandes, onze on été acceptées.
Elles concernent, là encore un large éventail de sujets. Ceux-ci s’étendent, en effet, depuis des recherches d’ordre biologique jusqu’à des sujets purement techniques et chirurgicaux ou interventionnels.
On peut placer dans la première catégorie l’étude des variations quantitatives de l’activité pro-inflammatoire des leucocytes neutrophiles chez les sujets ayant subi une transplantation cardiaque ou sous assistance circulatoire (Dr. Bouabdallaoui, Hôpital de la Pitié-Salpêtrière)
C’est également le cas des travaux concernant l’impact du système ST2/IL-33 du donneur et du receveur sur la survie et le rejet aigu après transplantation cardiaque (Dr. A. Galeone, Hôpital de la Pitié-Salpêtrière)
C’est encore le cas des travaux du Dr. P-E Noly concernant la Recherche d’une nouvelle cible thérapeutique dans la défaillance ventriculaire droite et les troubles du métabolisme mitochondrial du ventricule droit dans l’hypertension pulmonaire post-embolique. (Institut Cardiologique de Montréal et Hôpital Marie-Lannelongue).
C’est encore le cas avec le développement d’un modèle de transplantation cardiaque hétérotopique chez le rat permettant d’étudier la mobilisation cellulaire dans différentes conditions de rejet. (Dr. Nguyen. Hôpital Bichat, Institut Cardiologique de Montréal).
Il en va de même du projet concernant la classification moléculaire des mésothéliomes pleuraux malins (Dr. De Wolf. CHU de Lille).
On peut associer à cette catégorie la recherche sur l’innocuité et la concentration tissulaire du Paclitaxel chez les sujets atteints d’artérite des membres inférieurs au stade IV et traités par angioplastie. (Dr. A. Boitet. Hôpital Henri Mondor et Presbyterian Hospital, Pittsburgh, USA).
Dans la seconde catégorie de recherches on peut placer la mise au point d’un nouveau dispositif d’annuloplastie mitrale après insuffisance mitrale ischémique (Dr. Fiore, CHU Henri Mondor).
C’est également le cas des travaux du Dr. Pierre Demondion concernant la mise au point d’un nouveau système d’assistance circulatoire pulsée (Hôpital de la Pitié-Salpêtrière, Institut Cardiologique de Montréal).
C’est enfin le cas de la mise au point d’une technique de fenestration sur mesure par Laser des prothèses vasculaires intra-aortiques (endoprothèses) pour le traitement des lésions de la crosse aortique (Dr. E. Faure. CHU de Montpellier).
Pour ce qui est de l’année en cours et de 2017, plusieurs demandes de bourse ont déjà été enregistrées. Les dossiers sont en cours d’examen.
Nous en reparlerons.
Tous ces travaux et recherches entrent dans le cadre de « masters » ou de thèses de science. Ils entrent donc tout à fait dans le cadre et les buts que s’est fixé l’ADETEC depuis sa création.
Seront-ils fructueux et auréolés de succès ? C’est une autre question et c’est tout l’intérêt et le mystère de la recherche.
En attendant tentons par notre action de faire en sorte qu’ils puissent se réaliser et être menés à terme.
Aussi, merci à tous et à toutes pour votre soutien sans faille.
Dr. Jean BACHET, FEBTCS
Président de l’ADETEC.
La Vie de l'Association (Georges Malgoire)
Chers Amis, bonjour
Dans la convocation à cette assemblée générale vous avez trouvé le détail des principales figures comptables de l’année 2015. Nous ne les reproduirons pas intégralement ici.
Ainsi que nous vous l’avions déjà indiqué précédemment le montant de nos réserves, constituées essentiellement par un important legs perçu en 2013, demeure suffisant pour permettre à l’ADETEC de poursuivre une politique hardie de financement de projets de recherches et de bourses accordées à de futurs chirurgiens du cœur (ceux sur qui nous pourrons compter demain).
Ainsi, en milliers d’€ :

L’année 2015 a été marquée par le versement d’importantes aides à des laboratoires de recherches (IMM Recherche, AVIATOR, CAVIAAR), associations d’entraide (Syndrome de Marfan, Maison de Parents) et boursiers (7 bourses), soit

Notons que de l’an 2000 à aujourd’hui, l’ADETEC a délivré plus de 70 bourses à de futurs chirurgiens cardio-vasculaires, chiffre à comparer à celui de 71 équipes de chirurgie cardio-vasculaire exerçant en France (Cf : Haute Autorité de Santé-2007). Un ancien boursier ADETEC serait-il présent dans chacune des équipes ?

Pour leur part, les frais de fonctionnement et de collecte ont été maîtrisés, malgré l’augmentation significative des frais postaux et les efforts de promotion de l’association que nous avons entrepris.
L’année 2016 débute sur une information positive désormais le Professeur VERHOYE qui vient de prendre la direction du service de chirurgie cardio vasculaire du CHU de Rennes a donné des instructions pour que dorénavant les opérés de son service soient informés de la collaboration existant entre le CHU et l’ADETEC. Ceci devrait nous permettre d’augmenter notablement le nombre d’adhérents.
A ce jour, le Comité scientifique de l’ADETEC examine plusieurs projets de recherches dans le domaine de la chirurgie cardio vasculaire entrepris par divers laboratoires que nous pourrions aider. Une prévision budgétaire de 180.000 € leur a été réservée.
Par ailleurs, et faisant suite à vos décisions prises précédemment en Assemblée Générale, le Ministère de l’Intérieur vient de nous faire part de la décision favorable prise par le Conseil d’État concernant notre souhait de modification de l’article 8 de nos statuts, ouvrant désormais la possibilité de voter en Assemblée Générale par correspondance ou en ligne.
Une condition est mise à notre compte : celle de rédiger un « Règlement intérieur » qui fixera les procédures de vote lors de nos Assemblées Générales.
Un projet a été adressé pour accord au Ministère de l’intérieur qui a pour but de préciser les règles de vote selon que les adhérents autorisés à voter s’expriment :
- Par leur présence à l’Assemblée.
- Préfèrent donner un pouvoir « à personne dénommée » ou en blanc.
- Par correspondance,
- Par internet (en ligne),
- Dépouillement le lendemain de l’AG (par le secrétaire de l’Assemblée et 2 assesseurs)
Les résultats seront publiés rapidement sur le site et dans le bulletin d’informations qui donne le compte-rendu de l’Assemblée.
Cette année, votre Assemblée Générale du 5 avril 2016 a procédé à l’approbation des résolutions suivantes :
- Renouvellement des membres du Conseil d’Administration : ont été reconduits les mandats du professeur Daniel GUILMET, du docteur Jean BACHET et du professeur Jean-Philippe VERHOYE.
- Approbation du Bilan et des Comptes de l’année 2015 dont le résultat net est négatif de 228 535.77 €
- Approbation du budget de l’année 2016
- Quitus donné au Conseil pour sa gestion en 2015
- Imputation sur le report à nouveau du montant des résultats.
- Merci encore pour votre fidélité. Je vous adresse à tous et aux vôtres tous mes vœux de bonne santé.
Le Secrétaire Général, Georges MALGOIRE
DU REMPLACEMENT VALVULAIRE AORTIQUE, A LA TAVI
Par les docteurs Jean BACHET (Président de l’ADETEC) et Christophe CAUSSIN (Responsable du département de cardiologie interventionnelle de l’IMM)
Pourquoi ? (Dr Jean Bachet)
La valve aortique est une sorte de miracle technologique. La structure à 3 feuillets de chaque valvule est extrêmement résistante malgré son épaisseur de quelques dixièmes de mm si l’on considère, par exemple, que la valve s’ouvre et se ferme environ 2 milliards et demi de fois en une vie de 85 ans.
Hélas la qualité de cette valve change au cours de la vie, soit sous l’influence de maladies comme le rhumatisme articulaire aigu, d’une anomalie anatomique congénitale, soit beaucoup plus fréquemment, dans les pays développés, du fait du vieillissement. Les valves vont s’épaissir, se calcifier, et finir le plus souvent par entrainer un rétrécissement serré, c’est à dire un obstacle à l’éjection du sang du ventricule gauche vers l’aorte.
Très vite, dès que l’on a pu disposer de la circulation extracorporelle à la fin des années 50, des chirurgiens ont tenté de s’attaquer à cette pathologie. C’est Harken à Boston qui en 1960 implante la première prothèse valvulaire aortique en position anatomique. Mais surtout c’est Albert Starr, jeune chirurgien de Portland (Oregon), qui va développer avec l’aide d’Edwards, ingénieur biomédical, une prothèse à bille contenue dans une cage qui va devenir bientôt universellement adoptée et connaitra un succès énorme à travers ses différents modèles jusque dans les années 80.
En France, dès 1965, Jean-Paul Binet et surtout Alain Carpentier pensent à utiliser une valve aortique de porc cousue sur un support tripode pour remplacer la valve malade. Cette prothèse préservée dans du formol va se révéler très vite défaillante. Mais en 1968, Carpentier développe un mode de préservation par le Glutaraldéhyde qui va se révéler très efficace et qui reste encore la méthode universelle de choix.
De nombreux chirurgiens et industriels vont se lancer dans l’élaboration et la production de prothèses aussi bien mécaniques que biologiques. Beaucoup seront retirées du marché du fait de leurs défauts structurels ou de leurs taux de complications. A la fin des années 70 apparaissent les prothèses mécaniques modernes, à deux ailettes, sans charnière, faites en pyrolite de carbone et donc théoriquement inusables. Toutes ces prothèses mécaniques ont cependant un inconvénient. Elles obligent à la prise permanente d’anticoagulants, pour éviter des accidents de thrombose ou d’embolie à partir de caillots formés sur ou dans la prothèse.
Au milieu des années 70, Marian Ionescu, chirurgien de Leeds propose une prothèse biologique faite avec du péricarde de veau tanné par du Glutaraldéhyde. Il est suivi dès le début des années 80 par Carpentier et Edwards qui mettent au point une prothèse similaire et qui est actuellement (dans ses différentes évolutions) la bioprothèse la plus utilisée dans le monde. Beaucoup d’autres suivront avec plus ou moins de succès. Mais ces bioprothèses ont également un inconvénient majeur. Elles se détériorent avec le temps et d’autant plus vite qu’elles sont placées chez des sujets plus jeunes.
Quoi qu’il en soit, ces différentes prothèses entraînent une révolution dans le traitement des maladies cardio-vasculaires. Ce, d’autant que les résultats opératoires et à long terme deviennent vite excellents. Ainsi, dans les pays industriels, la mortalité hospitalière de cette chirurgie est actuellement inférieure à 1% chez les adultes jeunes et à 5% chez les personnes âgées de plus de 75 ans.
Pourquoi dès lors se porter vers d’autres solutions thérapeutiques ?
C’est, qu’en plus de 50 ans de remplacements valvulaire aortique et après la mise en place de plusieurs millions de prothèses, on a assisté à une évolution des indications.
En Europe et dans les pays industrialisés, jusque dans les années 80, les prothèses sont essentiellement implantées chez des sujets jeunes souffrant des conséquences du rhumatisme articulaire aigu (maladie infectieuse peu grave mais qui, par réaction du système immunitaire, s’attaque aux valves cardiaques et qui a pratiquement disparu dans les pays industrialisés). Les prothèses implantées sont alors surtout mécaniques. Depuis les années 90 les prothèses sont surtout implantées chez des sujets âgés, du fait de la dégénérescence de la valve naturelle. Les prothèses implantées sont essentiellement biologiques.
C’est que la population a largement évolué. Si l’on examine la pyramide des âges et l’espérance de vie dans les pays développés on constate une augmentation drastique des personnes de plus de 65 ans. Ainsi les prévisions démographiques considèrent qu’en 2050 le taux de personnes de plus de 65 ans devrait être de 50% dans l’Union Européenne et de 60% au Japon. Et il apparaît qu’actuellement, 35% des personnes de plus de 75 ans ont un certain degré de sclérose de la valve aortique et 2,4% un rétrécissement pathologique, ces taux montant à 40% et 4%, respectivement, après 85 ans.
Mais il y a plus. Plusieurs études ont montré que 33 à 60% des octogénaires soufrant d’un rétrécissement valvulaire aortique symptomatique ne se voyaient pas offrir la chirurgie du fait de leur état général, de la présence d’autres affections, de leur perte d’autonomie, etc.
Et puis on ne peut nier la tendance sociale et plus ou moins consciente d’aller vers des traitements moins agressifs, moins douloureux ou pénibles physiquement ou psychologiquement.
C’est pourquoi Alain Cribier, cardiologue au CHU de Rouen, va développer l’idée, puis la mise en place d’une technique de remplacement de la valve aortique en passant par une artère périphérique (l’artère fémorale, en général) et en plaçant cette prothèse à l’intérieur de la valve naturelle malade où elle est maintenue grâce à un support métallique dilatable. C’est ce que les Anglo-Saxons vont dénommer TAVI pour « Transcutaneous Aortic Valve Implantation ». La première prothèse est placée à Rouen en 2002.
Plusieurs marques et modèles ont été développés depuis, mais les deux prothèses les plus utilisées sont la prothèse Sapien de Cribier –Edwards dans ses différentes évolutions et la prothèse Core-valve développée dès 2005 par Jacques Seguin, alors chirurgien parisien.
Les expériences cliniques se sont multipliées et actuellement près de 30.000 prothèses ont été mises en place.
Les résultats sont satisfaisants et surtout s’améliorent avec le temps et les modifications technologiques apportées par les fabricants.
Un certain nombre de problèmes restent certes en suspens. En particulier le taux de fuites péri-valvulaires résiduelles et surtout le taux de blocs de conduction auriculo-ventriculaires obligeant à la mise en place d’un pacemaker, ne sont pas négligeables. Et il reste à démontrer que les résultats à moyen terme seront aussi bons que ceux de la chirurgie conventionnelle.
Le TAVI deviendra-t-il dans l’avenir le mode essentiel sinon exclusif de traitement du rétrécissement valvulaire aortique ? C’est un vaste débat qui, pour l’instant reste ouvert.
Docteur Jean BACHET
Comment ? (Dr Christophe Caussin)
Qu'est-ce que la TAVI ?
La TAVI (Transcatheter Aortic Valve Implantation), ou Implantation de Valve Aortique par voie percutanée, est une invention française, due aux travaux du Professeur Cribier, et qui consiste à réparer la valve aortique par voie artérielle, plutôt que de recourir à une opération de chirurgie traditionnelle, évitant entre autres, l'ouverture du thorax et l'utilisation d'une assistance circulatoire mécanique.
Cette pratique, destinée, au premier abord, aux personnes dont l'opération traditionnelle est contre indiquée, pour des raisons d'état de santé ou de risques de comorbidité importants, s'améliore sans cesse, et entre en concurrence avec la chirurgie cardiaque.
Le Docteur Christophe Caussin, responsable de l'équipe de cardiologie interventionnelle à l'Institut Mutualiste Montsouris (Paris), nous explique, précisément, ce qu'il en est.
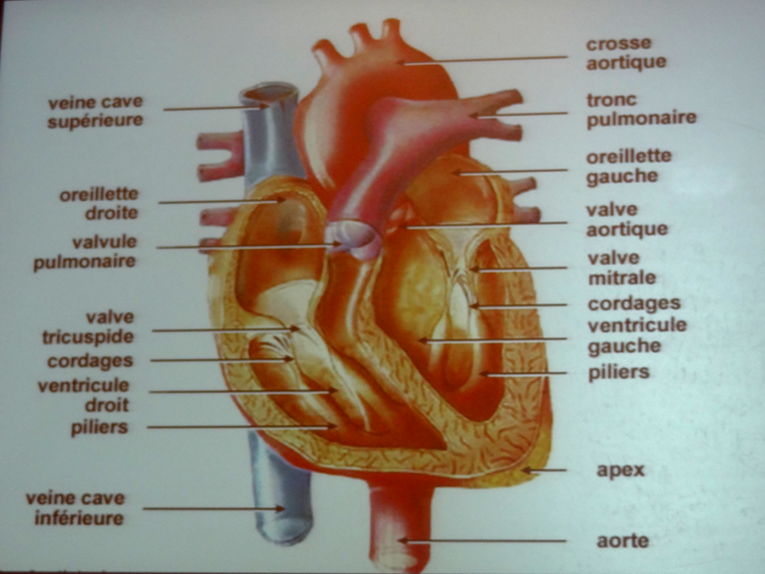
Dans le cœur, il y a 4 valves ; celles du cœur gauche sont le plus souvent atteintes, en particulier chez les sujets âgés (15% à + de 85 ans) d’où des symptômes d’angor.
La chirurgie classique est le traitement de référence, avec un risque très faible, de l’ordre de 0.5 %. Mais 30 % des patients ne peuvent pas être opérés. C’est là que se positionne alors le recours à la TAVI.
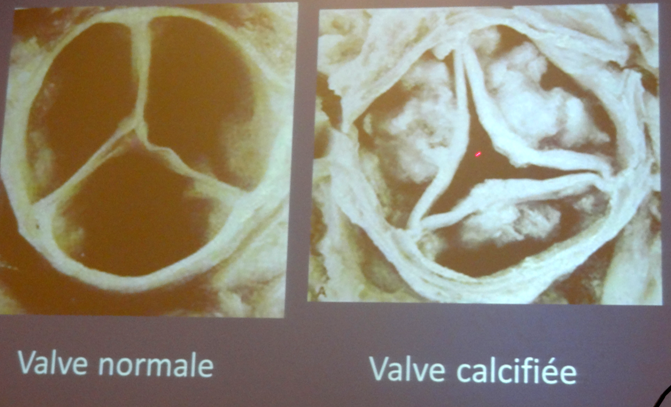
Contrairement à la chirurgie, dans la TAVI la valve du patient demeure en place. La prothèse est introduite par l’artère fémorale, contrainte dans une gaine ; on retire alors la gaine et la prothèse peut se déployer, écrasant alors les valves naturelles. On la positionne à environ 10 à 12 mm en dessous du plan des artères coronaires.
Notons que depuis 2011 cette intervention est prise en charge par la Sécurité Sociale.
En pratique, la valve va être mesurée de façon extrêmement précise, car trop petite, il y a des risques de fuite, et trop grosse, on court le risque de rupture de l’aorte. Le type de calcification devra également être pris en compte.
Durant l’intervention on va être obligé de procéder à un arrêt du cœur de 10 à 15 secondes afin de bien positionner la prothèse et d’éviter qu’un afflux de sang ne la déplace.
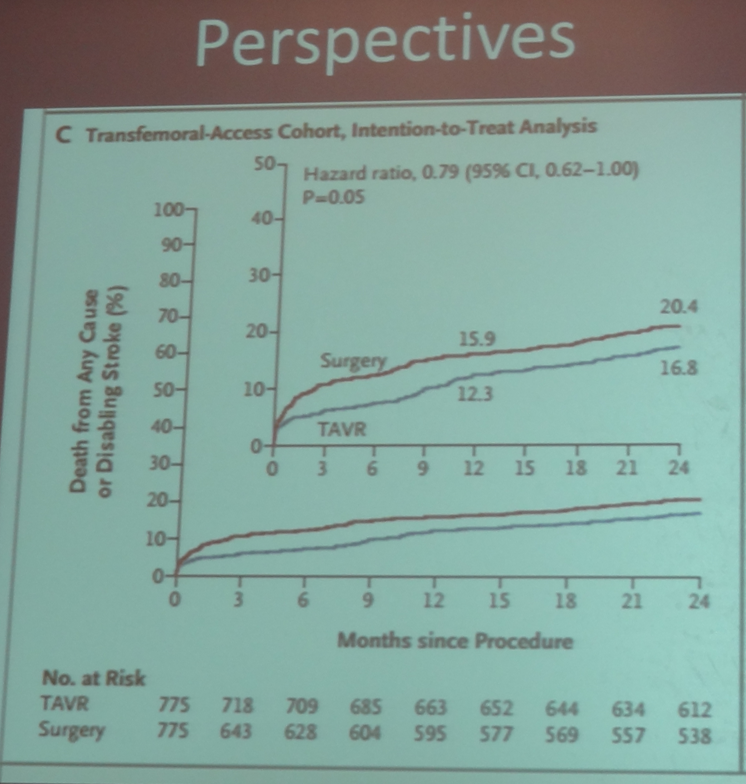
Désormais, les progrès accomplis sont tels que, même sur les « hauts risques », le taux de mortalité de la TAVI est analogue à celui constaté en chirurgie traditionnelle.
Signalons enfin qu’en présence d’une précédente prothèse dégénérée, il est désormais possible d’implanter une TAVI, pour autant qu’il s’agisse d’une ancienne bioprothèse. C’est l’une des raisons qui fait qu’en cas de chirurgie traditionnelle, on implante désormais plutôt une bioprothèse qu’une prothèse mécanique.
Enfin, le laboratoire Edwards vient de mettre au point une prothèse dotée d’un dispositif anti fuites, ce qui est un progrès significatif.
Je vous remercie pour votre attention.
Dr Christophe CAUSSIN
Vidéo de la présentation TAVI lors de l'AG 2016
cliquez sur le lien pour accéder à la vidéo
Impact du système ST2/IL-33 du donneur et du receveur sur la survie des receveurs et le rejet aigu après transplantation cardiaque (Dr Antonella GALEONE)

Le système ST2/IL-33 est impliqué dans les réponses immunitaires et dans la protection du muscle cardiaque. La protéine ST2 appartient à la famille des récepteurs de l’IL-1 et présente deux iso formes : une forme membranaire (ST2 ligand, ST2L) et une forme soluble (sST2).
L’IL-33 représente son ligand fonctionnel ; sST2 se lie à l’IL-33 et agit comme un récepteur leurre l’empêchant ainsi de stimuler les récepteurs membranaires ST2L
Le poumon est le principal producteur de ST2, les autres sources incluent les cellules endothéliales et les cardiomyocytes. ST2L est produit par les cardiomyocytes après stimulation mécanique et l’IL-33, produite par les fibroblastes cardiaques, a un rôle de cardio-protection dans le contexte des lésions des cardiomyocytes dues au stress mécanique. Un taux élevé de sST2 peut limiter les effets biologiques de l’IL-33, résultant en une cardio-protection inadéquate et un risque élevé de dysfonction ventriculaire.
Chez les patients avec un infarctus aigu du myocarde, les taux sériques de sST2 sont corrélés de manière inverse à la fonction ventriculaire gauche et sont prédictifs de mortalité.
Chez les patients avec défaillance cardiaque chronique, les taux sériques de sST2 sont corrélés à la BNP et l’augmentation des taux de sST2 est un facteur prédictif de mortalité et de transplantation cardiaque.
Le taux sérique de sST2 augmente dans le contexte d’un rejet aigu après transplantation cardiaque, il présente une association linéaire avec la sévérité du rejet et se réduit significativement après thérapie anti rejet.
Les études expérimentales ont montré que l’administration de l’IL-33 prolonge la survie du greffon cardiaque chez les souris suite à l’induction de la réponse immunitaire Th2. La protéine sST2 est donc considérée comme un bio marqueur d’intérêt dans l’insuffisance cardiaque car elle reflète le stress biomécanique du cardiomyocytes.
Á l’état actuel aucune étude s’est intéressée au système ST2/IL-33 chez le donneur d’organe, avec l’idée que le taux de sST2 peut refléter l’état de souffrance du greffon cardiaque et son niveau initial de tolérance immune et prédire le risque de dysfonction ultérieure.
Cette étude permettra d’évaluer pour la première fois l’utilité du dosage de sST2 chez le donneur dans le cadre du dépistage du mauvais greffon qui reste une problématique majeure dans la transplantation cardiaque ou jusqu’à 25% des receveurs développent une dysfonction du greffon.
L’objectif principal de cette étude est d’ évaluer l’association entre le taux sérique de sST2 des donneurs et la mortalité à 30 jours des receveurs.
Les objectifs secondaires comprennent : l’évaluation de l’association entre le taux sérique de l’IL-33 des donneurs et les événements (mortalité et/ou dysfonction du greffon) à 30 jours des receveurs ; l’évaluation de l’association entre le taux sérique de sST2 et de l’IL-33 des donneurs et les événements (mortalité et/ou dysfonction du greffon) à un an des receveurs; l’évaluation de l’association entre le taux sérique de sST2 et de l’IL-33 des receveurs et/ou les événements (mortalité et dysfonction du greffon) à 30 jours et à un an des receveurs ; l’évaluation de l’association entre le taux sérique de sST2 et de l’IL-33 des donneurs et des receveurs et l’incidence de rejet aigu au cours de la première année.
Cinquante donneurs et cinquante receveurs consentants et consécutifs seront inclus dans l’étude. Un prélèvement sanguin sera effectué chez le donneur au bloc opératoire avant le prélèvement d’organe et chez le receveur avant la transplantation, à J7 et au moment de chaque biopsie endomyocardique prévu pendant la première année post-greffe. Les prélèvements seront ensuite centrifugés et le sérum stocké à -80°C jusqu’à l’analyse.
Les données pré et postopératoires, les résultats des biopsies endomyocardiques, des échocardiographies et des bilans sanguins de la première année post-greffe seront recueillies de façon prospective. Les taux sériques de sST2 et de l’IL-33 seront évalués d’après la méthode immun enzymatique ELISA.
L’étude se déroulera en trois phases (phase 1 : inclusion des patients, phase 2 : suivi des patients et recueil des données, phase 3 : dosage et analyse des résultats) et aura une durée prévisionnelle de l’étude de 3 ans.
L’étude a commencé le 29 février 2016 et 7 donneurs et 7 receveurs ont été inclus jusqu’à présent. Les résultats attendus sont que des taux sériques plus élevés de sST2 et moins élevés de l’IL-33 chez le donneur et chez le receveur soient associés à une mortalité du receveur à 30 jours et à un an plus importante et que des taux sériques plus élevés de sST2 et moins élevés de l’IL-33 chez le donneur et chez le receveur soient associés à un taux plus élevé de rejet aigu jugé sur score histologique.
Cette étude permettra d’avoir une meilleure compréhension du rôle du système ST2/IL-33 dans le contexte du rejet /dysfonction de greffon chez le transplanté cardiaque avec la perspective d’utiliser le niveau de sST2/IL-33 comme bio marqueur diagnostique d’une dysfonction primitive myocardique du donneur, comme bio marqueur pronostique d’une dysfonction primitive myocardique chez le receveur et comme bio marqueur diagnostique d’un épisode de rejet de greffe chez les receveurs, et aussi de développer des thérapeutiques modulant cette voie dans le cadre des dysfonctions primitives/rejets du greffon myocardique chez le receveur.
Dr Antonella Galeone
Imagerie moléculaire de l’élastase leucocytaire du thrombus endoluminal des anévrysmes de l’aorte abdominale expérimentaux (Dr Jean SENEMAUD)
Par le docteur Jean SENEMAUD

L'anévrysme de l’aorte abdominale (AAA) est une pathologie fréquente qui concerne 5% des sujets de plus de 65 ans. Son risque principal est le décès par rupture. Il existe peu de critères fiables prédisant l'évolution et la rupture des AAA. De nombreuses études ont démontré que le thrombus anévrysmal (caillot constitué dans la poche de l’anévrysme) constitue une zone très active biologiquement qui participe à la croissance et à la rupture de l'anévrysme. La mesure non invasive des activités biologiques du thrombus (protéolyse et oxydation) permettrait de juger du potentiel évolutif d'un AAA, ainsi que de l’efficacité des traitements (médicamenteux ou chirurgicaux, notamment endovasculaires). L'élastase leucocytaire est une serine-protéase qui possède un rôle de dégradation majeur au sein du thrombus anévrysmal et pourrait servir de marqueur d’activité.
L’objectif de ce projet est de développer un outil de visualisation en imagerie moléculaire de l’activité de l’elastase du thrombus anévrysmal dans un modèle animal (rat).
Dans un premier temps, un ligand peptidique (PL 721, breveté par l’unité) présentant une forte affinité pour l’elastase leucocytaire sera radiomarqué au Technetium-99m (99mTc) afin d’être utilisé comme traceur de l'élastase en scintigraphie. Dans un second temps, ce radiotraceur sera utilisé chez l’animal afin d’évaluer la spécificité de sa fixation au thrombus anévrysmal. Le modèle d’AAA par perfusion intra-aortique d’élastase chez le rat Wistar sera utilisé. Ce modèle d'AAA a tendance à cicatriser spontanément. L'injection répétée d'une bactérie, Porphyromonas gingivalis (Pg), empêche cette cicatrisation en mobilisant les neutrophiles. Quatre groupes de rats seront constitués : Trois recevront le PL721 : Un groupe AAA + Pg (n=10) un groupe AAA (n=10),un groupe témoin non opéré (n=5) et un groupe témoin AAA + Pg (n=5) recevra un peptide non relevant. La sélection des anévrysmes se fera préalablement par échographie. 3 semaines après constitution de l'AAA, une scintigraphie sera réalisée sous anesthésie générale avec injection de PL 721 radiomarqué au technétium avec acquisition à 20 et 40 minutes.
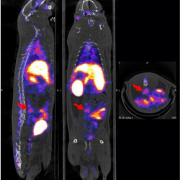
L’activité du thrombus sera évaluée par l’intensité et la répartition de la fixation du 99mTc-PL721 sur l’élastase leucocytaire en scintigraphie. Cette activité sera corrélée aux résultats d’analyses d'histologie (analyse des tissus) et de biologie : présence de neutrophiles, présence de NETs, immunomarquage de l’élastase, activité de l’élastase sue substrat chromogène, etc.
L'évaluation de l'activité élastasique du thrombus anévrysmal par l’imagerie moléculaire en scintigraphie n'a jamais été décrite. Une corrélation entre imagerie et histologie est attendue. Ce nouvel outil d'imagerie pourrait permettre de classer les AAA selon leur degré d'activité du thrombus et donc de risque. En perspective, ce projet permettra dans le futur d'utiliser cette technologie chez l'homme pour (1) préciser le moment optimal pour opérer les AAAs, (2) évaluer l'efficacité de nouveaux médicaments et (3) mieux surveiller les patients opérés.
Docteur Jean SENEMAUD
- 33 views
